Elektrofilné pridanie v organickej chémii
Pripojovacie reakcie sú charakterizované tvorboujedna chemická zlúčenina z dvoch alebo viacerých východiskových materiálov. Zvážme, že mechanizmus elektrofilného pridávania je vhodný pre príklady alkenes - nenasýtených acyklických uhľovodíkov s jednou dvojitou väzbou. Okrem nich vstupujú takéto transformácie aj iné uhľovodíky s viacerými väzbami, vrátane cyklických.
Etapy interakcie počiatočných molekúl
Elektrofilné spojenie prebieha vo viacerých prípadochstupňa. Elektrofil, ktorý má pozitívny náboj, pôsobí ako akceptor elektrónov a dvojitá väzba molekuly alkénu hrá úlohu donora elektrónov. Obidve zlúčeniny najskôr tvoria nestabilný p-komplex. Potom sa začína transformácia ß-komplexu do ϭ-komplexu. Tvorba carbocation v tomto štádiu a jeho stabilita určujú rýchlosť interakcie ako celku. Potom sa karbo-kokácia rýchlo vzájomne ovplyvňuje s čiastočne negatívne nabitým nukleofilom a vzniká výsledný produkt transformácie.
Účinok substituentov na reakčnú rýchlosť
Delokalizácia náboja (ϭ +) v karbokácii závisí odzo štruktúry pôvodnej molekuly. Pozitívny indukčný účinok, ktorý vykazuje alkylová skupina, vedie k nižšiemu náboju susedného uhlíkového atómu. V dôsledku toho sa v molekule s elektrónovým donorom zvyšuje relatívna stabilita katiónu, elektronická hustota p-väzby a reaktivita molekuly ako celku. Vplyv akceptorov elektrónov na reaktivitu bude opačný.
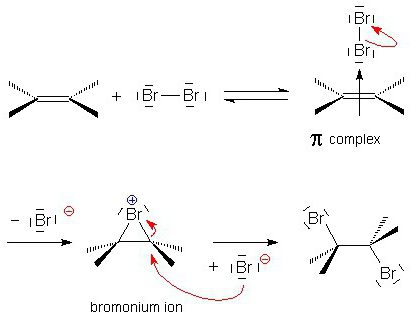
Mechanizmus pridávania halogénov
Pozrime sa podrobnejšie mechanizmus elektrofilní pridanie alkénov na príklad interakcie a halogénov.
- Halogénová molekula sa blíži k dvojitej väzbemedzi atómami uhlíka a je polarizovaná. Vzhľadom na čiastočne pozitívny náboj na jednom konci molekuly, halogén ťahá elektróny p-väzby. Tým vzniká nestabilný π-komplex.
- V ďalšom kroku elektrofilní častice spojený s dvoma atómami uhlíka, ktoré tvoria kruh. K dispozícii je cyklický "oniové" ion.
- Zvyšné nabité halogénové častice(pozitívne nabitý nukleofil) interaguje s iónom iónom a je pripojený na protiľahlej strane predchádzajúcej halogénovej častice. Konečný produkt, trans-1,2-dihalogénalkán, sa objaví. Podobne je prídavok halogénu na cykloalkén.
Mechanizmus pridávania halogénových kyselín

Elektrofilné prídavné reakcieHalogenidy a kyselina sírová prebiehajú inak. V kyslom prostredí reakčné činidlo disociuje na katión a anión. Pozitívne nabitý ión (elektrofil) napáda π-väzbu, spája sa s jedným z atómov uhlíka. Vznikajú karboxylové skupiny, v ktorých je susedný atóm uhlíka kladne nabitý. Ďalej karboxi-zácia reaguje s aniónom za vzniku konečného reakčného produktu.
Smer reakcie medzi asymetrickými činidlami a pravidlom Markovnikov

Elektrofilné pripojenie medzi dvomaasymetrické molekuly postupujú regioselektívne. To znamená, že sa vytvorí len jeden z dvoch možných izomérov. Regioselektivita opisuje Markovnikovské pravidlo, podľa ktorého je vodík pripojený k atómu uhlíka pripojenému k veľkému množstvu ďalších atómov vodíka (k viac hydrogenovanému).
Aby sme pochopili podstatu tohto pravidla, musíme si to uvedomiťže rýchlosť reakcie závisí od stability medzivrstvy. Vplyv donoru elektrónov a akceptorov bol diskutovaný vyššie. Elektrofilné pridanie kyseliny bromovodíkovej na propén tak vedie k tvorbe 2-brómpropánu. Stredný katión s pozitívnym nábojom na centrálnom uhlíkovom atóme je stabilnejší než karbokokácia s kladným nábojom na extrémnom atóme. V dôsledku toho atóm brómu interaguje s druhým atómom uhlíka.

Účinok substituenta na stiahnutie elektrónov na priebeh interakcie
Ak obsahuje zdrojová molekulasubstituent s odoberaním elektrónov, ktorý má negatívny indukčný a / alebo mezomerový účinok, elektrofilné pripojenie je v rozpore s vyššie uvedeným pravidlom. Príklady takýchto substituentov sú CF3, COOH, CN. V tomto prípade veľká vzdialenosť pozitívneho náboja od skupiny, ktorá odoberá elektróny, robí primárnu karbokáciu stabilnejšou. V dôsledku toho sa vodík spojí s menej hydrogenovaným atómom uhlíka.
Univerzálna verzia pravidla bude vyzerať takto: pri interakcii asymetrického alkénu a asymetrického činidla pokračuje reakcia pozdĺž cesty tvorby najstabilnejšej karbokácie.













